А.И. Федин, Л. П. Соколова
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н. И. Пирогова»
|
А.И. Федин |
Л. П. Соколова |
Пандемия COVID-19 продолжает разворачиваться и открывается нам все с новой и новой стороны. Мы поставлены в ситуацию необходимости адаптироваться, существовать в экстремальной жизненной ситуации [1, 2].
Наряду с инфекционным поражением мы переживаем своего рода эпидемию психосоматических заболеваний [3], которые усугубляют имеющуюся психопатологию и / или развиваются впервые. По данным метаанализа [4] 51 исследования (n = 18917) средней продолжительностью 77 дней (14–182 дня) было выявлено, что наиболее частыми психоневрологическими симптомами были: нарушение сна – 27,4% (21,4–34,4%), усталость – 24,4% (17,5–32,9%), когнитивные нарушения – 20,2% (10,3–35,7%), тревога – 19,1% (13,3–26,8%).
Тревожно-депрессивные расстройства сопровождаются и проявляются яркой вегетативной патологией в виде самых разнообразных клинических синдромов. Это и различные болевые синдромы, гипергликемия, артериальная гипертония, нарушения ритма сердечной деятельности, гастроинтестинальные, мочеполовые расстройства и др. Могут быть послеинфекционные аутоиммунная вегетативная полиневропатия и ганглиопатия. Проявления вторичной периферической вегетативной недостаточности в рамках последствий поражения дыхательной системы нам еще предстоит увидеть. Тревожно-депрессивные расстройства нередко запускают, усугубляют и вызывают манифестацию вегетативных патологических синдромов, ухудшая возможности постковидной реабилитации.
По данным публикаций, основанных на наблюдении исходов прошлых эпидемий, ущерб здоровью населения от шлейфа тревожных и психосоматических расстройств превышает во много раз ущерб здоровью непосредственно от вируса [5].
Известно, что варианты психологического реагирования на пандемию разнообразны [2]. Проявляется это в виде отрицания реальности величины угрозы (COVID-диссиденты) и самыми разнообразными психопатологическими феноменами. К счастью, большое количество населения проявляет оптимальную жизненную позицию, самый эффективный тип реагирования – мобилизацию внутренних психологических ресурсов для адаптации к социальному вызову. Но и эти пациенты нуждаются в медикаментозной психотропной и вегетотропной поддержке во время заболевания.
Практическая значимость исследований о психоэмоциональных особенностях реагирования, о вариантах медикаментозной помощи с целью коррекции и предупреждения запуска неадекватных психоэмоциональных и, что особенно важно, психосоматических и вегетативных патологических синдромов очень высока [6].
Углубление знаний в этом направлении позволяет более взвешенно выстраивать лечебные и профилактические мероприятия [7].
В нашем опубликованном исследовании проведено обследование 66 пациентов (30 мужчин и 36 женщин, средний возраст – 61 год), проходивших лечение от коронавирусной инфекции в ФГБУ «Клиническая больница № 1» УД Президента РФ (Москва) и в университетской неврологической клинике в ГБУЗ «Городская клиническая больница № 15 им. О. М. Филатова» ДЗ Москвы [8]. Применяли ряд современных психодиагностических методик, таких как «Страх коронавируса» (The Fear of COVID-19 Scale) [9], «Covid-19: Индекс перитравматического дистресса» (Covid-19 Peritraumatic Distress Index) [10], «Методика неоконченных предложений» (Metode d’Induction Motivationelle), адаптированная в СССР в 1989 году [11], «Тест воздействия стрессовых событий» (Impact of Event Scale) [12], «Опросник оптимизма» (Resilience Inventory-Self) [13].
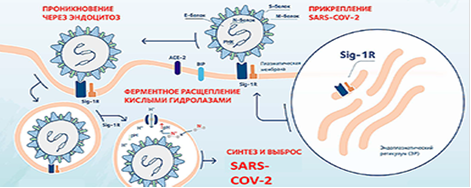
Рисунок 1. Предполагаемое влияние лигандов сигма1‑рецепторов на репликацию коронавирусной инфекции. Цит. Phadke M., Saunik S. Drug Dev Res. 2020; 81 (5): 541–543.
Обозначения: Sir-1R – сигма1‑рецептор, АСЕ-2 – тип рецепторов внутренних органов и сосудов.
В корреляционном анализе (линейный коэффициент корреляции Пирсона и непараметрический критерий – коэффициент Спирмена) использовались как абсолютные значения медицинских показателей (уровня ферритина в крови, С-реактивного белка, Д-димера, SpO2), степени поражения легких (согласно показаниям компьютерной томографии), так и нормированные в соответствии с принятой медицинской практикой определения нормы. Подобная процедура (корреляционный анализ в абсолютных и нормированных значениях) была проведена и в отношении психологических показателей, таких как страх COVID-19, индекс перитравматического дистресса, уровня воздействия стрессового события.
В результате было выявлено отсутствие корреляции между медицинскими показателями (признаками органического поражения) с уровнем перитравматического дистресса. Это наблюдение демонстрирует, что выраженность психологического дистресса не зависит от тяжести заболевания и реального поражения, а зависит от личностных особенностей пациента, его эмоциональной преддиспозиции, смыслового опосредствования болезни человеком [14]. Кроме того, отсутствие выявленной корреляции также демонстрирует, что у коронавируса нет патологического влияния на эмоциональный статус. Степень выраженности тревожно-депрессивных проявлений, связанных с СOVID-19, – это реализация тревожной настроенности, декомпенсация имеющегося тревожно-депрессивного синдрома на фоне пандемии (стресса) [15, 16].

Рисунок 2. Дизайн двойного слепого плацебо-контролируемого рандомизированного клинического исследования флувоксамина при COVID-19. Цит. Eric J. Lenze et al. JAMA. 2020; 12: E1‑E9.
Становится все более очевидным, что медикаментозная терапия, предупреждающая манифестацию и декомпенсацию патологических психовегетативных синдромов, является важнейшей для снижения тяжести протекания коронавирусной инфекции и улучшения прогноза для выздоровления и реабилитации.
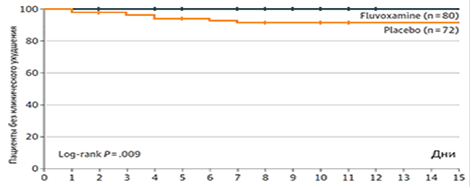
Рисунок 3. Результаты исследования флувоксамина при COVID-19. Цит. Eric J. Lenze et al. JAMA. 2020; 12: E1‑E9.
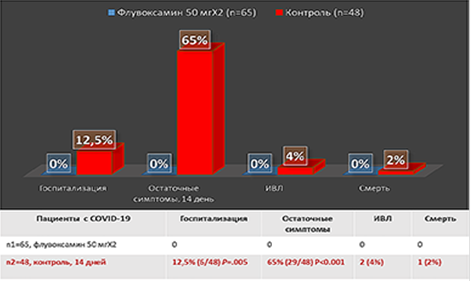
Рисунок 4. Влияние флувоксамина на прогноз течения коронавирусной инфекции. Цит. Seftel D. et al. Open Forum Infectious Diseases, 2021; ofab050.
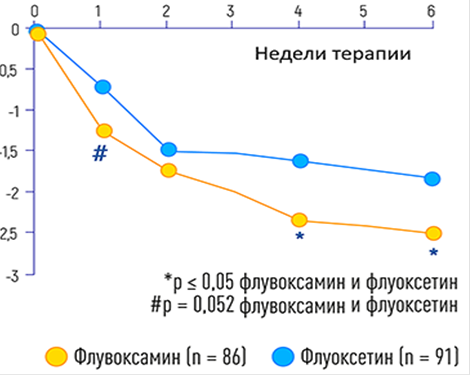
Рисунок 5. Редукция нарушений сна по шкале Гамильтона (пункт 17). Цит. Dalery J., Honig A. Hum Psychopharmacol. 2003. V. 18 (5): 379–384.
Скрининг лекарств выявил два набора агентов, проявляющих противовирусную активность: ингибиторы трансляции мРНК и регуляторы сигма-рецепторов. Все лекарства из второй группы были из очень разных классов, но имели одно общее свойство – взаимодействие с сигма-рецепторами [17].
Сигма-рецепторы широко представлены в организме человека, в том числе в различных структурах ЦНС. Места максимального скопления сигма1‑рецепторов – гиппокамп, зубчатая извилина, гипоталамус, обонятельные луковицы, различные корковые слои, группа нейронов в стволе мозга (locus caeruleus), компактная часть черной субстанции, красное ядро, задний шов, задний рог спинного мозга. Их концентрация особенно высока в зонах, ответственных за память, эмоции, сенсорное (болевое) восприятие и тонкую моторику.
Согласно гипотезе «рецепторов-шаперонов», сигма1‑рецептор функционирует как ключ, обеспечивающий сворачивание (фолдинг) полипептидных цепей белков.
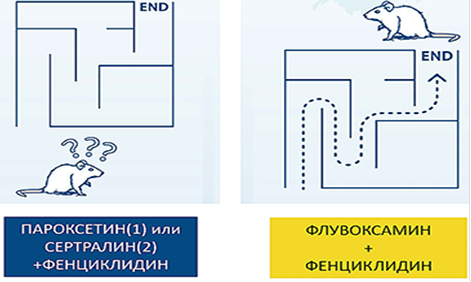
Рисунок 6. Флувоксамин устраняет когнитивные нарушения, вызванные фенциклидином (антагонистом NMDA-рецепторов). Цит. Ishima T. et al. Open Clin Chem J. 2009; 2: 7–11.
Агонисты сигма1‑рецепторов активируют клеточный метаболизм. Сигма1‑рецепторы регулируют различные ионные каналы (например, калиевые, кальциевые и хлорные, NMDA-рецепторы), высвобождение нейротрансмиттеров, транспорт липидов, передачу сигнала нейротрофического фактора головного мозга (BDNF), миелинизацию, нейрито- и синаптогенез, что заключает в себе высокий терапевтический потенциал лигандов сигма1‑рецепторов. Модулирующий эффект сигма1‑рецепторов на нейротрансмиттерные системы включает усиление глютаматергической, холинергической, серотонинергической нейротрансмисии. Агонисты сигма1‑рецепторов могут модулировать широкий спектр нейрональных эффектов, в том числе ключевой механизм влияния сигма1‑рецепторов на процессы обучения и памяти.
Учитывая широкую представленность сигма1‑рецепторов в организме, и в первую очередь в ЦНС, и их модулирующую роль на клеточном и нейротрансмиттерном уровне, сигма1‑лиганды рассматриваются как многообещающие субстанции-мишени, воздействие на которые позволит влиять на многие патологические состояния, такие как депрессия, тревога, когнитивный дефицит, аналгезия, иммунодефицит и др. Именно сигма-рецепторы и препараты, влияющие на их активность, рассматриваются и используются в качестве противовирусной защиты при лечении коронавирусной инфекции.
Многие перепрофилированные лекарства, включенные в схемы терапии COVID-19, являются лигандами сигма1‑рецепторов. Предполагается, что действие лигандов сигма1‑рецепторов, локализованных в эндоплазматическом ретикулуме, тормозит в нем ранние этапы репликации вируса, помогает замедлению течения инфекции, предотвращает обострение заболевания и / или создает временное окно для созревания защитного иммунного ответа (рис. 1) [18].
Из известных на сегодняшний день лигандов сигма-рецепторов наиболее сильным агонистом является антидепрессант из группы СИОЗС – флувоксамин. В связи с этим были начаты клинические исследования препарата при COVID-19.
По результатам двойного слепого плацебо-контролируемого рандомизированного клинического исследования с включением 152 пациентов (рис. 2), проведенного в США, было продемонстрировано, что у пациентов, получающих флувоксамин в течение 7 дней с первых симптомов COVID-19, не было зарегистрировано ни одного случая, соответствующего критериям ухудшения и госпитализации [19]. В то же время в группе плацебо 8,4% пациентов достигли первичной конечной точки (соответствие по двум критериям, в том числе О2 < 92%), 5,5% госпитализированы (4–21 день), 1,4% переведены на ИВЛ (10 суток). Разница между группами статистически достоверна (p = 0,009). Результаты исследования представлены на рис. 3.
По данным другого исследования, у пациентов с коронавирусной инфекцией, находящихся на флувоксамине в низкой дозировке (100 мг / сут) в течение 14 дней, не было зафиксировано ни одного случая госпитализации, ИВЛ или смерти (рис. 4) [20].
Как известно, одним из ведущих патологических клинических проявлений депрессии и невротических расстройств (в том числе развившихся после COVID-19) является нарушение сна. Кроме того что этот синдром ухудшает самочувствие пациентов, он утяжеляет течение болезни, снижает резистентность организма и активность иммунологической защиты. Положительным действием флувоксамина является доказанное действие препарата на уровень мелатонина (рис. 5) [21].
Как показано на рис. 5, флувоксамин более значимо по сравнению с флуоксетином способствовал редукции нарушения сна с 1‑й недели приема, это сравнение еще более существенным было на 4‑й и 6‑й неделях лечения.
Кроме того, только флувоксамин, в отличие от других антидепрессантов, в том числе сертралина и пароксетина, устраняет когнитивные нарушения (рис. 6), вызванные фенциклидином (антагонистом NMDA-рецепторов) [22, 23].
Этот факт также добавляет бонусов препарату с точки зрения целесообразности и эффективности включения его в схему лечения постковидных депрессий, учитывая, что именно когнитивные расстройства разной модальности, в первую очередь нарушение уровня внимания, «мозговой туман» беспокоят пациентов длительное время на этапе реабилитации.
К другим механизмам, возможно, имеющим влияние на предупреждение осложнений при ранней терапии COVID-19, следует отнести обсуждаемое противовоспалительное действие флувоксамина и антикоагуляционное за счет действия на серотониновые транспортеры тромбоцитов. Последние следует учитывать при использовании антикоагулянтов.
23 апреля 2021 года флувоксамин был включен Национальным институтом здоровья – NIH (основной центр правительства США, ответственный за исследования проблем здравоохранения) в Американские стандарты терапии COVID-19 с нейтральной оценкой для ранней терапии амбулаторных пациентов с неосложненным COVID-19.
По сравнению с дорогостоящей терапией ремдесвиром (~13 тыс. рублей за флакон) флувоксамин может стать доступной альтернативой у пациентов с начальными проявлениями COVID-19. Так, в исследовании Seftell было достаточно наличия у пациента 1 упаковки флувоксамина № 15 по 100 мг (по 50 мг х 2 раза в день, 2 недели) для раннего предупреждения осложнений. Стоимость такой упаковки флувоксамина в России составляет всего порядка 700 рублей (по данным сайта Apteka. ru, для препарата «Рокона»). На сегодняшний день пока что недостаточно накопленных данных для повсеместного внедрения флувоксамина в стандарты терапии COVID-19. Мы ожидаем результатов многочисленных исследований по флувоксамину, которые сейчас ведутся в США, Канаде, Южной Корее, Бразилии и др.
В связи со всем вышесказанным в условиях пандемии SARS-CoV-2 флувоксамин следует рассматривать как антидепрессант первого выбора у пациентов с депрессией или невротическими расстройствами (например, обсессивно-компульсивным расстройством), поскольку потенциальная польза от его применения может распространяться дальше лечения основного заболевания. В России флувоксамин представлен двумя антидепрессантами: «Феварином» и «Роконой». Наиболее доступным является препарат «Рокона».
Напомним рекомендации назначения флувоксамина при депрессии или невротических расстройствах:
1. Для не получавших ранее терапию флувоксамином и пожилых пациентов целесообразно начинать с половинной дозы или меньшей (50–25 мг). Терапевтическая доза составляет 100–300 мг / сут.
2. Учитывая известное отсроченное терапевтическое действие, целесообразно в начале лечения флувоксамином создать «мостик» противотревожной терапии в течение первых 2–3 недель. Часто с этой целью используют феназепам 0,5–1 мг на ночь, но в условиях коронавирусной инфекции, на фоне дыхательной недостаточности, мы опасаемся использовать бензодиазепины по причине их выраженного миорелаксирующего, снотворного и угнетающего дыхательный центр действия. Поэтому в качестве транквилизирующего «мостика» нередко используют небензодиазепиновые транквилизаторы (аминофенилмасляная кислота), а также малые нейролептики (сульпирид, алимемазин).
P. S.: В исследованиях флувоксамина для ранней терапии COVID-19 использование противотревожных «мостиков» не применялось.
3. Сроки лечения: оценка эффективности препарата проводится через 4–6 недель. Длительность курса определяется исходя из преморбидного фона, коморбидности, вида и тяжести тревожно-депрессивного расстройства. Согласно последним рекомендациям ВОЗ терапия депрессии средней и тяжелой степени тяжести должна осуществляться не менее 9 месяцев после выхода в ремиссию.
Заключение
Пандемия коронавирусной инфекции принесла в нашу жизнь не только медицинские проблемы, но и, безусловно, психологические, социальные. Врачи общесоматической медицины, не психиатры, вынуждены заниматься терапией психоэмоциональных и психовегетативных проявлений, в силу того что психологические проблемы однозначно переходят в область соматических, усугубляют и утяжеляют протекание болезни, влекут плохой прогноз для выздоровления.
Пандемия несет и большой ценностно-смысловой феномен: мы проходим испытание на прочность наших медицинских знаний и врачебной интуиции, умения работать коллегиально, работать в области междисциплинарных проявлений, на стыке специальностей.
За списком литературы обращайтесь в редакцию.


